1 Der Brombeerrost (Phragmidium violaceum)
Der Brombeerrost (Phragmidium violaceum) [1] ist ein häufig vorkommender Rostpilz, der Brombeersträucher in unseren Breiten gerne befällt, was in der Regel keinen großen Schaden an der Wirtspflanze nach sich zieht. Deshalb findet man in der Literatur [1, 2, 3] vergleichsweise spärliche Angaben zu morphologischen Details der verschiedenen Sporenstadien. Der Brombeerrost tritt in 5 verschiedenen Entwicklungsstadien auf (siehe Abschn. 3) und führt keinen Wirtswechsel durch, d.h. alle Entwicklungsstadien laufen auf Brombeerblättern ab. Auffällig und mit freiem Auge erkennbar sind besonders die gelb leuchtenden Sporenlager der Sommersporen sowie die schwarzen Lager der Wintersporen. Das Ziel dieser Arbeit ist es, auch die weniger sichtbaren Stadien zu dokumentieren und alle 5 Sporengenerationen mikroskopisch abzubilden.
2 Standortbeschreibung
Der Garten, aus dem die Proben für diese Arbeit entnommen wurden, liegt im österreichischen Kärnten auf einer Seehöhe von 445 m unterhalb eines bewaldeten Nordhanges. Aufgrund der Lage ist die Sonneneinstrahlung im Frühjahr und im Herbst vergleichsweise gering, zusätzlich rinnt in wenigen Meter Entfernung ein kleiner Bach entlang der Grundstücksgrenze. Diese zwei Faktoren sind für ein feuchtes und relativ kühles Mikroklima verantwortlich. Die verwilderten Brombeeren wachsen zwischen Brennnesseln, einem Weigelienstrauch und wildem Wein (siehe Abbildung 1). Der große Konkurrenzdruck und die zeitweise geringe Sonneneinstrahlung durch die Hangneigung machen die eigentlich sonnenliebenden Brombeeren empfänglich für parasitäre Pilze. Der Brombeerrost taucht deshalb verlässlich jedes Jahr auf und ist ein spannendes Objekt für mikroskopische Untersuchungen.
Geplant war die Unternehmung als mikroskopisches Kleinprojekt im Urlaub, das über ein paar Tage verteilt einige Stunden Arbeit verursachen sollte. Aus folgenden Gründen ist daraus eine recht umfangreiche Studie geworden, die sich (mit geringer Intensität) über drei Gartensaisonen hingezogen hat:
- An der untersuchten Stelle (ca. 10 m² im Garten) wachsen zwei verwilderte Brombeersorten (siehe Abbildung 2). Ich vermute, dass es sich um die armenische Brombeere (Rubus armeniacus) und die wilde Brombeere (Rubus fruticosus) handelt. Rubus armeniacus hat Blätter, die auf der Unterseite stark behaart sind. Die Zweige sind durch harte Stacheln mit roter Basis gekennzeichnet, die auf einem furchigen Trieb wachsen. Die Stacheln von Rubus fruticosus sind weicher und dünner, die Blätter an der Unterseite deutlich weniger behaart. Mir ist aufgefallen, dass die Blätter von Rubus armeniacus signifikant anfälliger für den Befall durch den Brombeerost sind, im Vergleich zur heimischen Art Rubus fruticosus.
- Wie oben erwähnt, finden die Details zum Entwicklungsgang des Brombeerrostes relativ wenig Beachtung, und diese Rostpilzart wird oft in Anlehnung an den wirtschaftlich viel bedeutenderen Getreiderost (Puccinia graminis) behandelt. Bildliche Darstellungen der Sporenformen von Phragmidium violaceum sind in der Literatur daher nur eingeschränkt zu finden.
- Im Gegensatz zu anderen Rostpilzen führt Phragmidium violaceum keinen Wirtswechsel durch. Daher sind einzelne Sporenstadien (z. B. Aecidiosporen und Uredosporen) im Vergleich zu Rostpilzarten mit Wirtswechsel nicht so leicht zu unterscheiden. Zusätzlich, auch dies im Gegensatz zu anderen Rostpilzen, wachsen sowohl Uredosporen als auch Aecidiosporen an der Blattunterseite.
- Neben den Rostpilzen wachsen fallweise weitere Pilze an den vom Rostpilz befallenen Stellen. Die von diesen Hyperparasiten gebildeten Sporen und Hyphen sind für den Hobbybotaniker, wie ich einer bin, nicht ohne weiteres von den Erscheinungsformen des eigentlichen Rostpilzes zu unterscheiden.

3 Entwicklungsstadien des Brombeerrostes
Rostpilze sind Pflanzenparasiten, die für ihr Wachstum auf Wasser und Nährstoffe aus ihrer Wirtspflanze angewiesen sind. Die Fortpflanzungsmechanismen der Rostpilze sind sehr komplex, und der evolutionäre Hintergrund dieser komplexen Vorgänge ist noch nicht vollständig geklärt.
Abbildung 3 zeigt eine Darstellung der Entwicklungsstadien des Brombeerostes, auf deren Erscheinungsbild in den folgenden Abschnitten detaillierter eingegangen wird. Die Sporen können entweder in Anlehnung an das sie bildende Sporenlager bezeichnet werden, oder der Einfachheit halber mit römischen Zahlen von 0 bis IV durchnummeriert werden.
Der zeitliche Ablauf bezieht sich auf den oben beschriebenen Fundort, dessen Pflanzenwachstum aufgrund des Mikroklimas im Vergleich zu Plätzen auf ähnlicher Seehöhe (450 m) typischerweise 2 – 3 Wochen verzögert ist. Die Sporenbildung der Generation 0 (Spermatien) startet ca. Ende April auf der Oberseite der jungen Blätter. Ausgehend von den Empfängnishyphen in den Spermogonien bilden sich zwischen Mitte Mai und Mitte Juni die Aecidiosporen (Generation I) an der Unterseite der Blätter aus. Auf die Frühjahrssporen der Generation 0 und I folgen die Sommersporen (II, Uredosporen), die von Ende Juni bis Ende August aktiv sind. Im Spätsommer ab Mitte August treten dann die Wintersporen (Teleutosporen, Generation III) auf, die leicht anhand der deutlich sichtbaren, schwarz gefärbten Sporenlager erkennbar sind. Zum Teil sind Teleutosporen und Uredosporen auf denselben Sporenlagern auffindbar.
Die Teleutosporen sind gegen Umwelteinflüsse gut geschützt und überwintern auf den abgestorbenen Blättern. Im nächsten Frühjahr ab Mitte April keimen aus den Teleutosporen die Basidiosporen (Generation IV), die dann die frischen Blätter der Brombeerpflanze infizieren. So wird die Basis für die Bildung neuer Spermogonien geschaffen, womit sich der Kreislauf wieder schließt.
3.1 Spermatien (Generation 0)
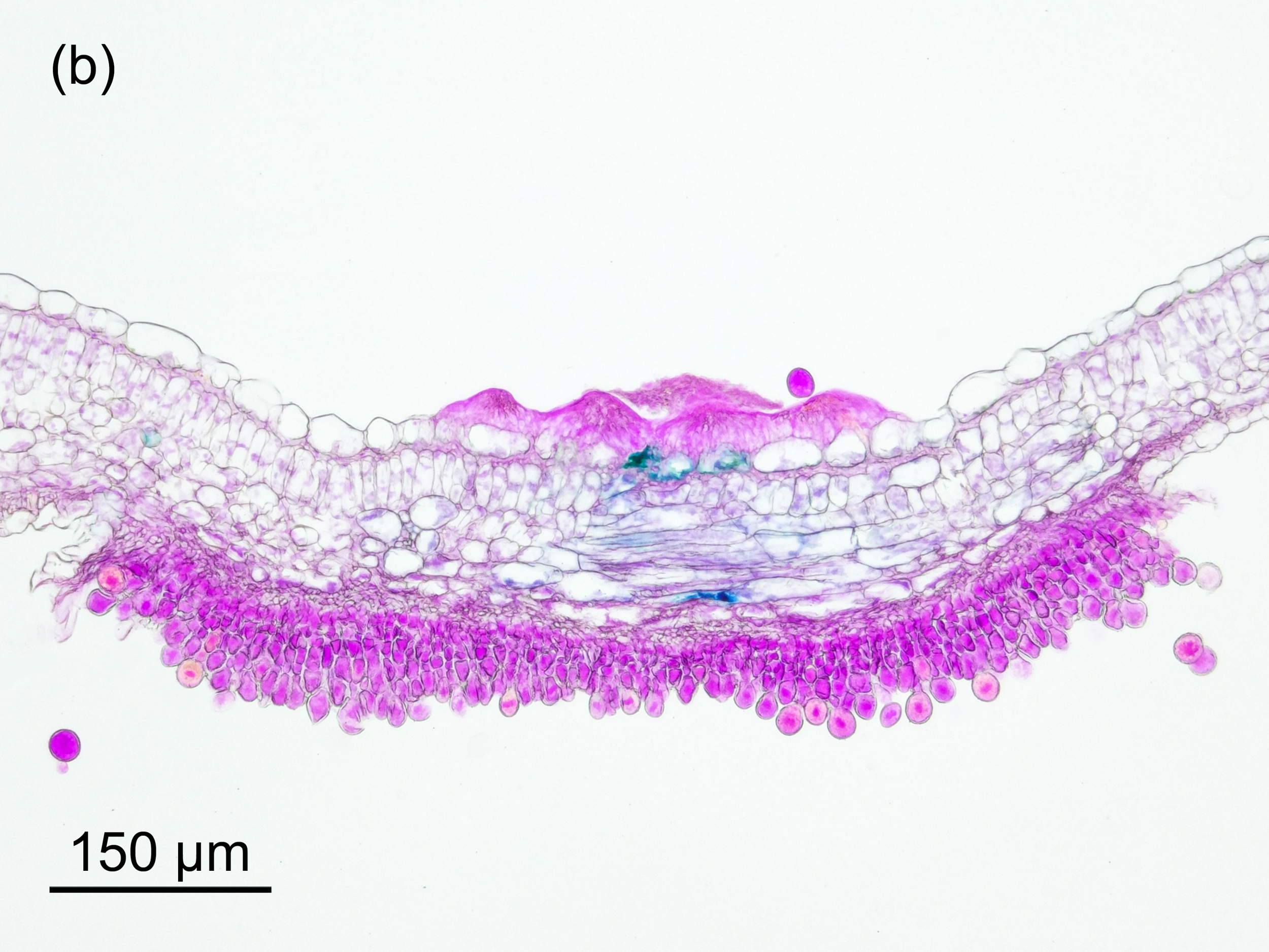
Die von den Basidiosporen infizierten frischen Blätter bilden Sporenlager aus, die anfänglich als grüner Fleck auf der Blattoberseite erkennbar sind. Der Infektionsvorgang findet nur statt, wenn das junge Blatt zumindest 16 h lang nass ist, bei Temperaturen oberhalb von 8 °C [1]. In weiterer Folge bildet sich in der Mitte dieses Flecks ein orangefarbenes Spermogonium aus, das einen Durchmesser von ca. 0,5 mm aufweist (Abbildung 4-a und b). Im Spermogonium werden dann die Spermatien gebildet, die von einem zuckerhältigen Nektar umgeben [3] sind. Insekten nehmen den Nektar mit den darin enthalten Sporen auf, und im Idealfall landet eine der Sporen auf der Empfängnishyphe eines benachbarten Spermogoniums.
Die Spermatien sind die einzige Sporengeneration, die einen geschlechtlichen Vermehrungszyklus darstellt. Im befruchteten Spermogonium werden nach kurzer Zeit an der Blattunterseite Aecidiosporen erzeugt, die für die weitere Verbreitung des Rostpilzes sorgen.
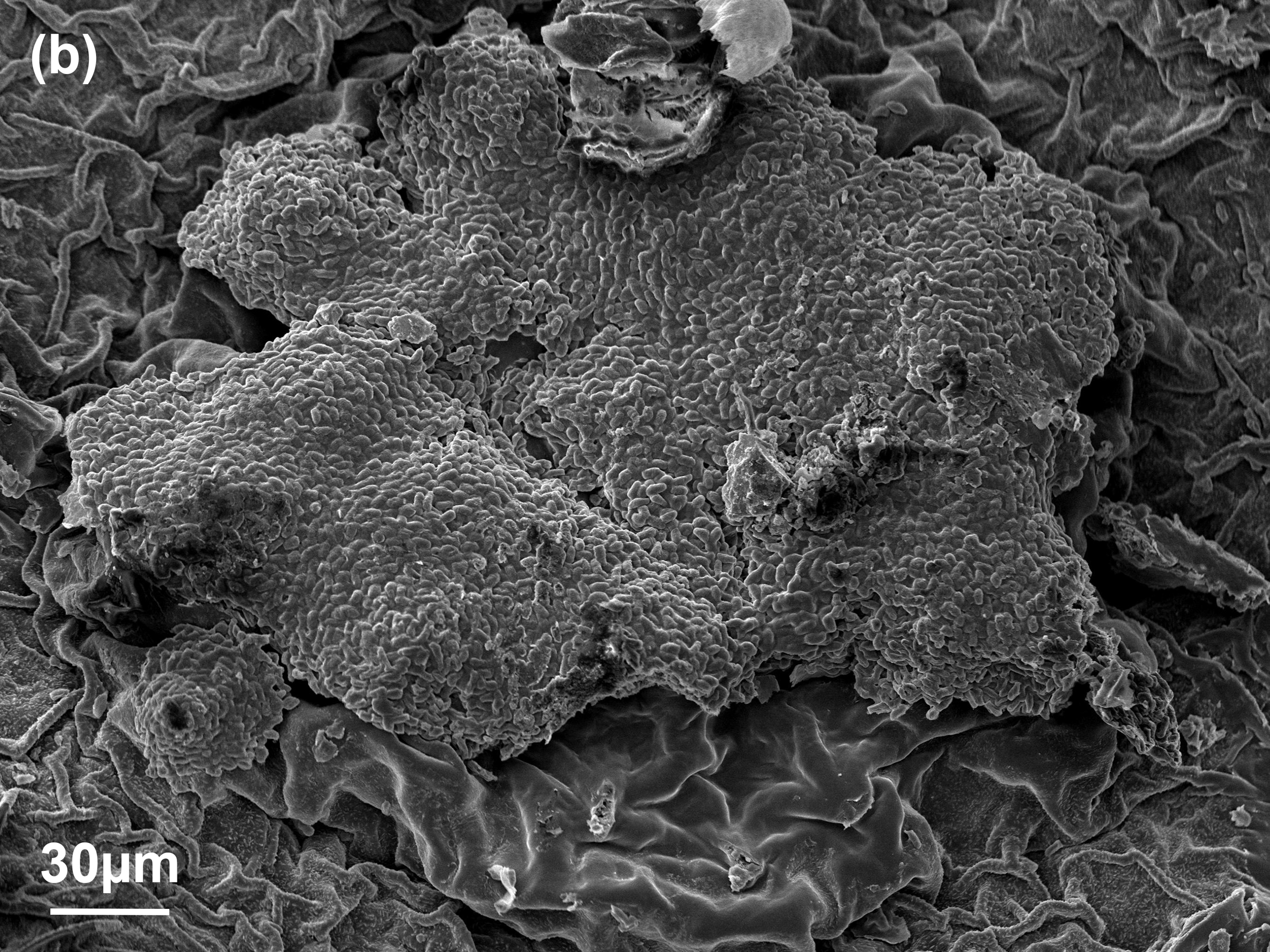
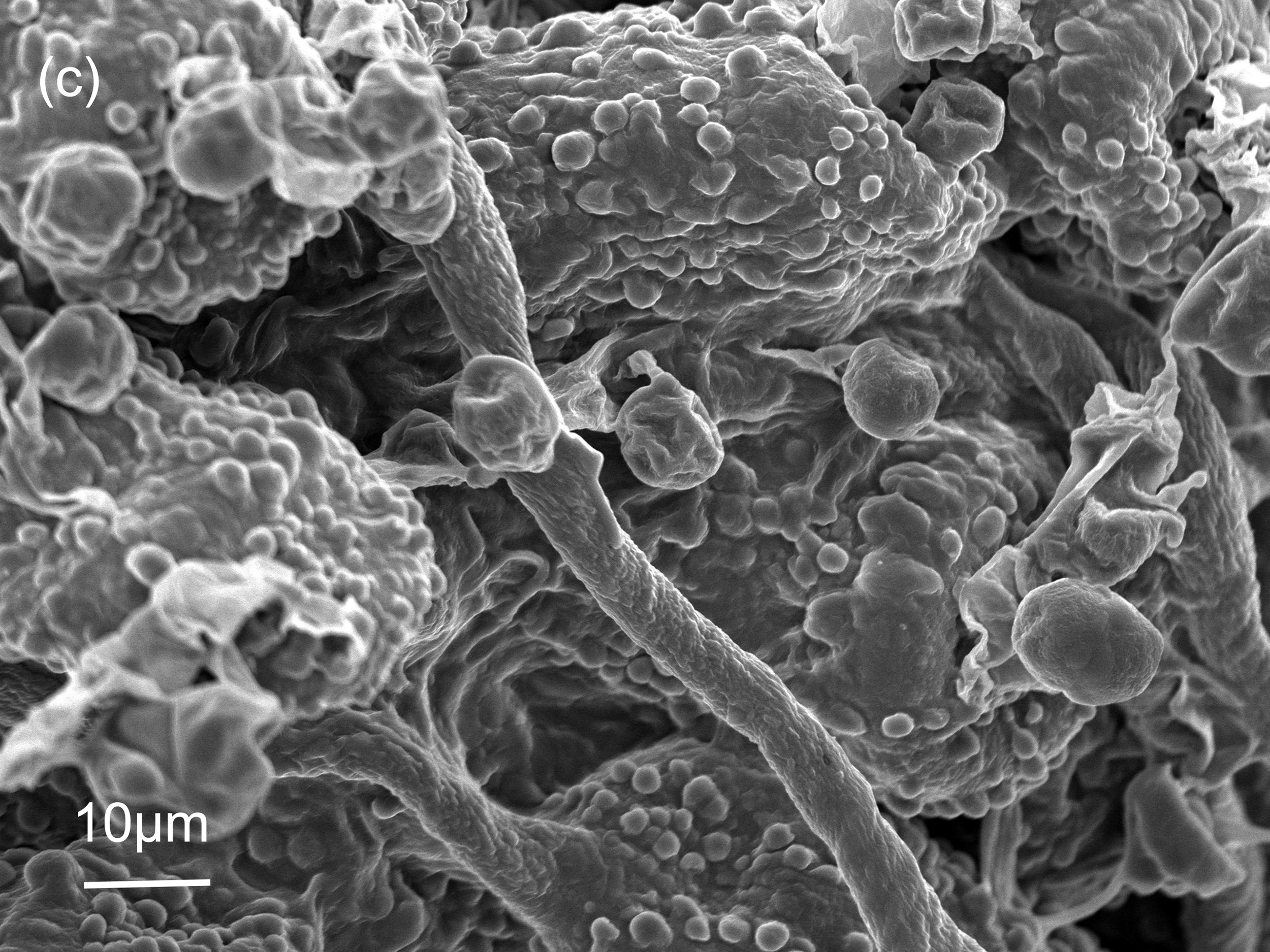
Die Spermogonien bleiben aufgrund ihrer geringen Größe und der unauffälligen Färbung gerne unerkannt. Zwei weitere Eigenschaften führen dazu, dass in der Literatur nur sehr wenige bildliche Darstellungen dieser Sporengeneration gibt: (1) Die Spermogonien bilden sich rasch zurück, sobald die auffälligeren Aecidiosporen an der Blattunterseite das Geschehen dominieren. (2) Aufgrund der Einbettung in einem zähflüssigen, zuckerhältigen Medium sind die einzelnen Spermatien selbst im Lichtmikroskop nur schwer zu erkennen. Erst im Paraffinschnitt (Abbildung 4-b) bzw. im Rasterelektronenmikroskop (REM) werden die zigarrenförmigen Spermatien sichtbar. Abbildung 4 (b bis d) zeigt solche Aufnahmen, aus denen die Größe des Spermogoniums sowie die Abmessungen der Spermatien erkennbar sind. Die typische Längsabmessung der Spermatien liegen zwischen 4,5 und 5,5 µm.
3.2 Aecidiosporen (Generation I)
Im Vergleich zu den Spermatien haben die Aecidiosporen ein gänzlich anderes Erscheinungsbild (Abbildung 5): Das Sporenlager ist leuchtend gelb bzw. orange, und die einzelnen Sporen sind selbst mit freiem Auge als feines Pulver erkennbar. Die Aecidiosporen sind kugelförmig und deutlich größer als die Spermatien, mit einem Durchmesser von ca. 20 µm. Auffällig sind die stacheligen Warzen an der Sporenoberfläche. Am Rand des Sporenlagers findet man gelegentlich sterile Zellen. Diese sind vermutlich Peridien, die eine glatte Oberfläche aufweisen und ursprünglich das wachsende Sporenlager bedeckten. In Abbildung 5-c sind solche Peridien am oberen Bildrand erkennbar.
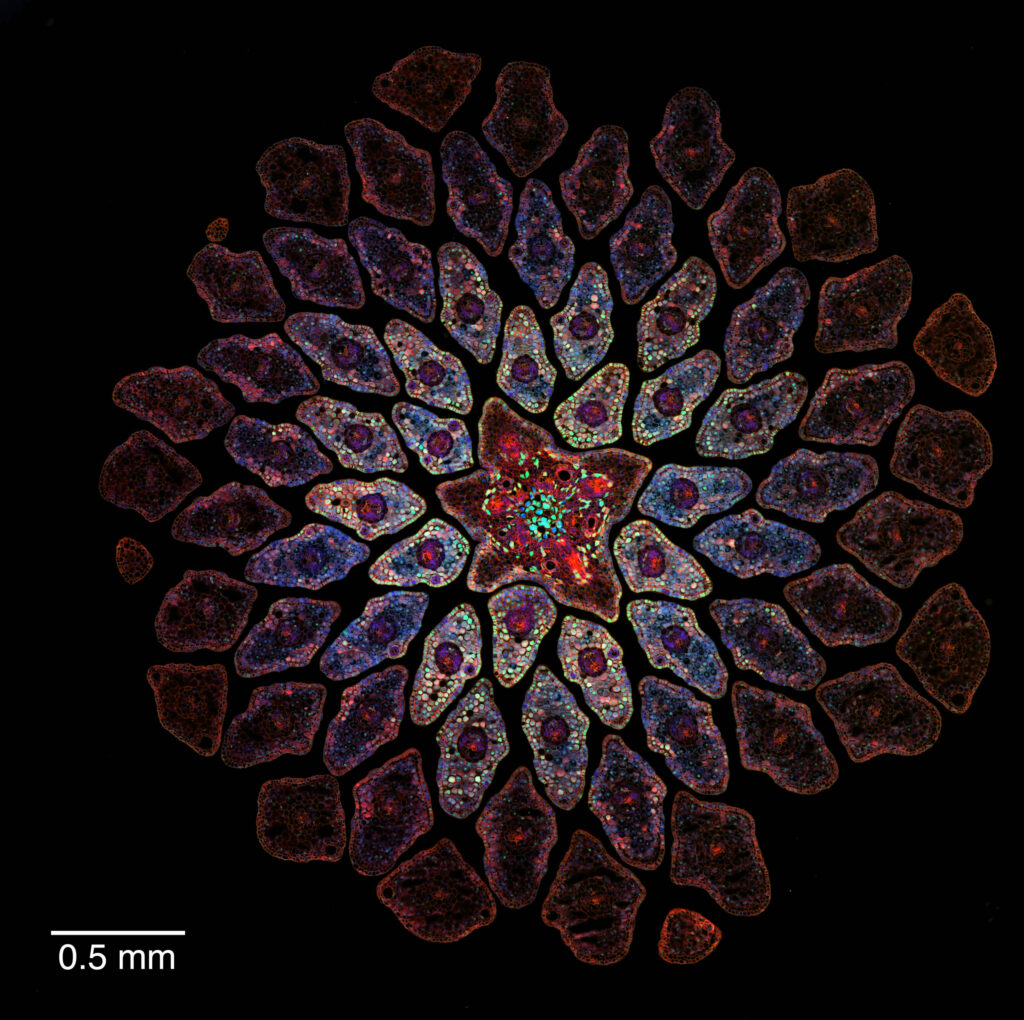
Der lichtmikroskopisch aufgenommene Paraffinschnitt in Abbildung 5-b gibt einen Eindruck der inneren Strukturen des vom Pilz befallenen Brombeerblattes mit dem Spermogonium auf der Oberseite und dem Aecidienlager auf der Unterseite. Die Aecidiosporen werden vom Wind vertragen. Wenn sie auf der Oberfläche eines Brombeerblattes landen, können sie dort auskeimen. Liegt eine Spaltöffnung in der Nähe, kann die keimende Spore ins Blattinnere vordringen und dort knapp unterhalb der Epidermis neue Sporenlager bilden, die Uredien.
3.3 Uredosporen (Generation II)
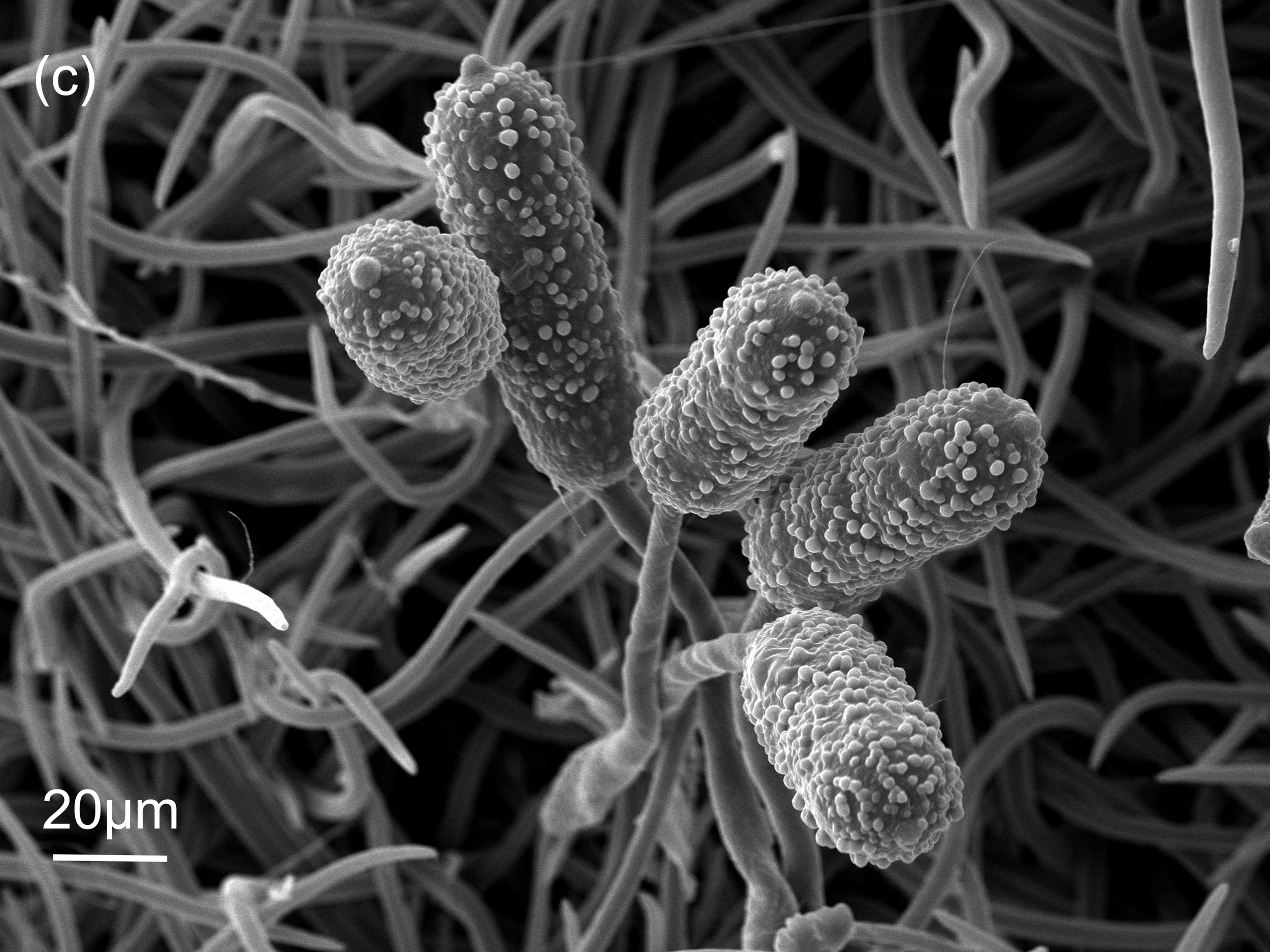
Im neu gebildeten Uredium reifen die Uredosporen heran (Abbildung 6), die für eine massenhafte Verbreitung der Rostpilze sorgen können. Im Fall des Brombeerrostes entstehen die Uredosporen ab Mitte Juni und können sich über mehrere Generationen bis Anfang September vermehren. Vom Aussehen her ähneln die Uredosporen (Durchmesser 18-20 µm) den Aecidiosporen und sind von diesen nur schwer zu unterscheiden. Sie sind nur geringfügig kleiner als die Aecidiosporen und wachsen ebenfalls an der Blattunterseite.
Folgende Merkmale können bei der Unterscheidung von Aecidio- und Uredosporen hilfreich sein:
- Die Uredosporen tragen an der Basis Reste des Stiels, an dem sie in den Uredien entstanden sind, siehe das grün markierte Rechteck in Abbildung 6-c. Dieser Stielrest ist allerdings nur gelegentlich im Mikroskop erkennbar und ist deshalb in meinen Augen nur bedingt als Unterscheidungsmerkmal hilfreich.
- Im anfänglichen Entwicklungsstadium im Frühjahr treten die Aecidiosporen gemeinsam mit Spermatien auf. Im späten Sommer keimen aus den Uredien auch erste Teliosporen. In solchen Fällen ist die Zuordnung eindeutig. Abbildung 8-d zeigt eine derartige Situation, wo Uredosporen in Kombination mit Teliosporen im REM sichtbar werden. Zusätzlich sind in dieser Aufnahme auch Peridien erkennbar. Die Sporangien lösen sich allerdings irgendwann von der Blattoberseite und Uredien können auch ohne die Gegenwart von Teleutosporen auftreten, wodurch die Zuordnung der Sporen zu Frühjahrs- bzw. Sommersporen erschwert wird.
- Die stacheligen Warzen der Uredosporen habe eine annähernd perfekte Kegelform (Abbildung 6-c), wenn sie aus der Oberfläche der Sporen hervortreten. Die Warzen der Aecidiosporen hingegen (siehe z.B. Abbildung 5-d) haben eine verbreiterte Basis am Grunde des Kegels, wodurch sie im REM-Bild recht eindeutig von den Warzen der Uredosporen unterscheidbar sind.
3.4 Teleutosporen (Generation III)
Im Spätsommer bildet sich die dritte Sporengeneration (Teleutosporen) heran, indem die beiden Kerne der Uredosporen verschmelzen und in weiterer Folge Teleutosporen gebildet werden. Deshalb treten phasenweise, wie oben erwähnt, Uredosporen und Teliosporen gemeinsam auf.
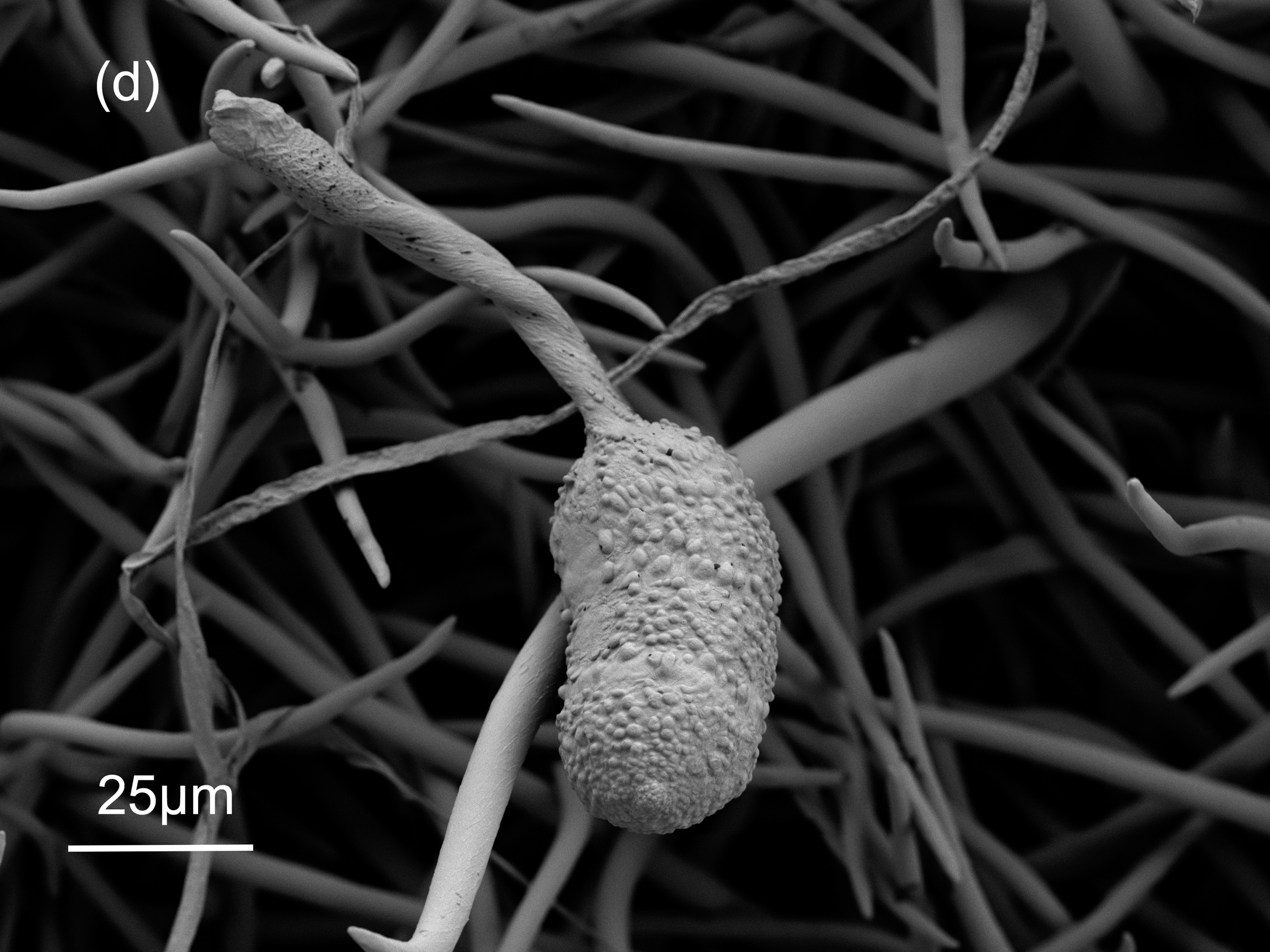
Der Befall mit Teleutosporen kann recht massiv ausfallen, siehe Abbildung 7-a. Die Teleutosporen bestehen aus einem Stiel und einem Kopf (Abbildung 7-b). Der Kopf ist in 3 – 5 Segmente unterteilt, die durch dunkle Melanin-Einlagerungen ihre braun-schwarze Färbung erhalten. Somit sind die Teleutosporen während der Überwinterung, die an den abgestorbenen Blättern stattfindet, vor schädigenden Umwelteinflüssen (Sonneneinstrahlung) gut geschützt.
Die Teleutosporen sind ca. 200 µm lang, davon entfällt knapp die Hälfte auf den gegliederten Kopf, der an seiner Oberfläche mit zahlreichen Warzen besetzt ist.
3.5 Basidiosporen (Generation IV)
Im zeitigen Frühjahr, wenn die Temperaturen steigen und die Umgebung ausreichend feucht ist, beginnen die Teleutosporen zu keimen, und an den Keimporen der Teleutospore treten gelb-orange Basidien hervor, siehe Abbildung 8-a. Diese Basidien sind das Schlüsselmerkmal der Ständerpilze (Basidiamycota), und somit zählen die Rostpilze zu dieser Gruppe. An den Basidien entstehen jeweils vier Basidiosporen (Sporengeneration IV), die lichtmikroskopisch [2, 4] erkennbar sind. Abbildung 8-b und c zeigen das Erscheinungsbild der Basidien, die aus den Teliosporen keimen, im REM. Ebenfalls ersichtlich sind die rundlichen Basidiosporen, deren Größe zwischen 5 und 10 µm liegt.
Die Basidiosporen werden durch Buller’sche Tröpfchen aktiv von den Basidien weggeschleudert und landen in weiterer Folge auf den frisch ausgetriebenen Blättern der Brombeerpflanze, wo sie zu keimen beginnen. So wird die nächste Sporengeneration 0 gebildet und der Entwicklungskreislauf des Brombeerrostes schließt sich.
4 Probenpräparation
Die Proben wurden alle an der in Abschn. 2 beschriebenen Stelle entnommen. Die frischen Proben wurden dann im Stereomikroskop ohne weitere Probenvorbereitung dokumentiert. Für die Untersuchung im REM wurden 5 x 5 mm² große Ausschnitte aus dem jeweiligen Brombeerblatt luftgetrocknet und anschließend mit Gold besputtert. Durch die Lufttrocknung kam es vereinzelt zu Präparationsartefakten (z.B. eingefallene Sporen), die aber hoffentlich das Gesamtergebnis nicht verfälschen.
Für die Präparation der botanischen Paraffinschnitte (Abbildung 5-b) wurde auf ein Protokoll aus [5] zurückgegriffen, mit Methylbenzoat als Intermedium und Xylol als Lösungsmittel für das Paraffin. Gefärbt wurden die Schnitte mit der Pianese-Färbung.
5 Zusammenfassung
Wie in Abschn. 2 erwähnt, war das Unterfangen etwas umfangreicher als ursprünglich geplant. Der Lebenszyklus des Brombeerrostes ist kompliziert, und die verschiedenen Stadien des Entwicklungsganges zu dokumentieren erfordert Aufmerksamkeit und Geduld. Schlussendlich ist es gelungen, alle 5 Stadien des Entwicklungsstadien des Brombeerrostes mikroskopisch zu dokumentieren.
Die Komplexität der Vermehrung dieser in fast jedem Garten oder Waldstück vorkommenden Pilzart war mir bis vor kurzem nicht bewusst. Das Reich der Pilze hat bekannterweise nicht nur Speisepilze zu bieten, und gerade die mikroskopisch kleinen Pilzarten sind immer wieder für Überraschungen gut. Auf 10 m² (ungepflegten) Gartens lässt sich mit dem Mikroskop offenbar einiges entdecken. Ich bin schon gespannt, was die restlichen 99 % des Gartens in den kommenden Jahren an Mikroskopieprojekten zu bieten haben.
6 Literatur
[1] R. R. Martin, M. A. Ellis, B. Williamson, und R. N. Williams, Hrsg., Compendium of Raspberry and Blackberry Diseases and Pests, Second Edition. The American Phytopathological Society, 2017. doi: 10.1094/9780890545720.
[2] R. N. Stringer, M. Crutchley, und D. Harries, „I get by with a little help from my friends …“, Balsam Post, Bd. 129, S. 30–35, 2020.
[3] M. Piepenbring, Mykologie: Diversität, Morphologie, Ökologie und Evolution der Pilze. Berlin, Heidelberg: Springer, 2022. doi: 10.1007/978-3-662-65075-2.
[4] G. Bedlan, „Brombeerrost“. https://www.bedlan.at/media/Schadbilder/Obst/Brombeere_Rost.pdf.
[5] M. Mulisch und U. Welsch, Hrsg., Romeis – Mikroskopische Technik. Berlin, Heidelberg: Springer, 2015. doi: 10.1007/978-3-642-55190-1.